
Nutlin-3 CAS: 890090-75-2 是一種小分子的 MDM2 拮抗劑,它主要通過阻斷 MDM2 與 p53 的結合來發揮作用。根據細胞中 p53 基因的狀態(野生型或突變/缺失),Nutlin-3 引發細胞凋亡(apoptosis)或細胞週期停滯(cell cycle arrest)的機制與結果有顯著差異。
以下是針對不同 p53 狀態的詳細解析:
在 p53 突變或缺失(p53 Mutant/Null)細胞中
雖然 Nutlin-3 的設計初衷是針對野生型 p53,但研究發現它在缺乏功能性 p53 的細胞中仍能透過其他標靶引發效應,或作為輔助治療策略。
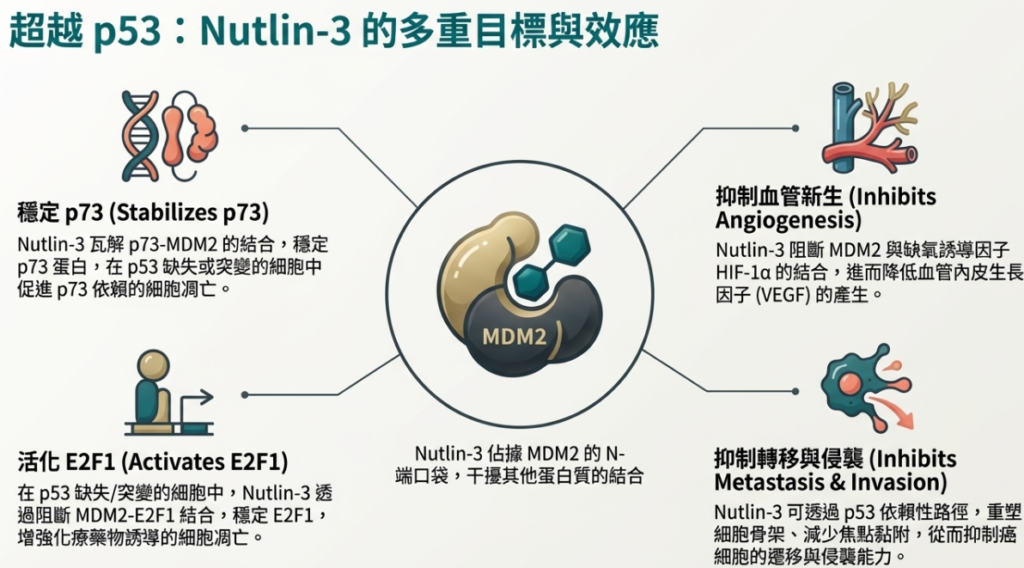
• 透過 p73 引發細胞凋亡:
◦ 機制: p73 是 p53 的同源蛋白,同樣能活化促凋亡基因。MDM2 也會結合 p73 的 N 端區域。Nutlin-3 能阻斷 MDM2 與 p73 的交互作用,導致 p73 蛋白穩定並累積。
◦ 結果: 在 p53 缺失的細胞中,累積的 p73 會上調 PUMA 和 Noxa,進而引發凋亡,。
• 透過 E2F1 引發細胞凋亡:
◦ 機制: MDM2 通常會結合轉錄因子 E2F1 並促進其降解或抑制其活性。在 p53 缺失/突變細胞中,Nutlin-3 可阻斷 MDM2 與 E2F1 的結合,增加「游離」E2F1 的水平。
◦ 結果: 游離的 E2F1 可被化療藥物誘導修飾,轉向促進促凋亡基因的表達。因此,Nutlin-3 能協同化療藥物(如 Cisplatin, Doxorubicin),增強 p53 缺失細胞的凋亡反應,。
• 選擇性殺傷策略(作為保護劑):
◦ 機制: 利用 Nutlin-3 預處理,使周圍正常的 p53 野生型細胞進入細胞週期停滯(受到保護),而 p53 突變的腫瘤細胞則繼續分裂,。
◦ 結果: 隨後使用針對分裂中細胞的細胞毒性藥物(如 Taxol 或 Gemcitabine),可選擇性殺死持續分裂的腫瘤細胞,而處於停滯期的正常細胞則免受毒性傷害。
在 p53 野生型(Wild-type p53)細胞中
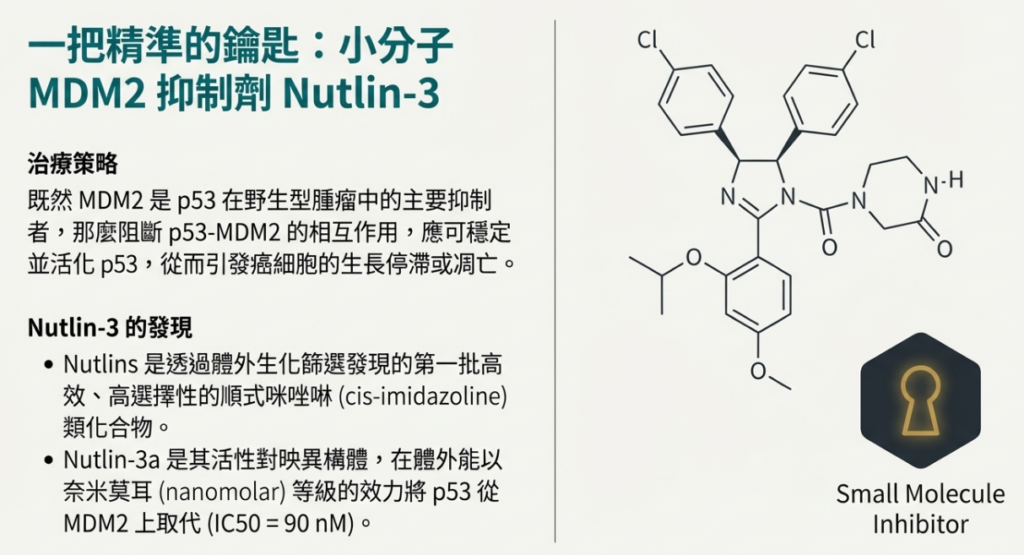
在 p53 功能正常的細胞中,Nutlin-3 的主要作用是恢復 p53 的活性。正常情況下,MDM2 會結合 p53 並促進其降解,而 Nutlin-3 會佔據 MDM2 上的 p53 結合口袋,導致 p53 穩定並累積,進而活化 p53 路徑,。
• 細胞週期停滯(Cell Cycle Arrest):
◦ 機制: Nutlin-3 活化的 p53 會誘導 p21 的表達,導致細胞停滯在 G1/S 和 G2/M 邊界,並耗盡 S 期的細胞。
◦ 結果: 這種停滯通常是可逆的(Quiescence),許多癌細胞在移除 Nutlin-3 後會恢復分裂。然而,若長期處理,部分細胞可能會進入**衰老(Senescence)**狀態,這與 mTOR 路徑的活性有關。研究顯示,如果 p53 能抑制 mTOR(透過上調 TSC2),細胞傾向於進入靜止期(Quiescence);若 mTOR 保持活化,細胞則傾向於衰老。
◦ 風險: 在某些細胞中,Nutlin-3 導致的停滯可能伴隨著 G2/M 調控因子(如 Cyclin B1)的耗盡,使細胞進入四倍體 G1 狀態(4N state)。這些細胞在藥物移除後可能發生核內複製(endoreduplication),產生具抗藥性的四倍體細胞。
• 細胞凋亡(Apoptosis):
◦ 機制: p53 活化後可透過兩種途徑引發凋亡:
1. 轉錄依賴途徑: p53 進入細胞核,啟動促凋亡基因(如 PUMA, Bax, Noxa)的轉錄。
2. 非轉錄途徑(粒線體途徑): 部分 p53 直接累積於粒線體,與 Bcl-2 家族成員相互作用,釋放促凋亡因子。
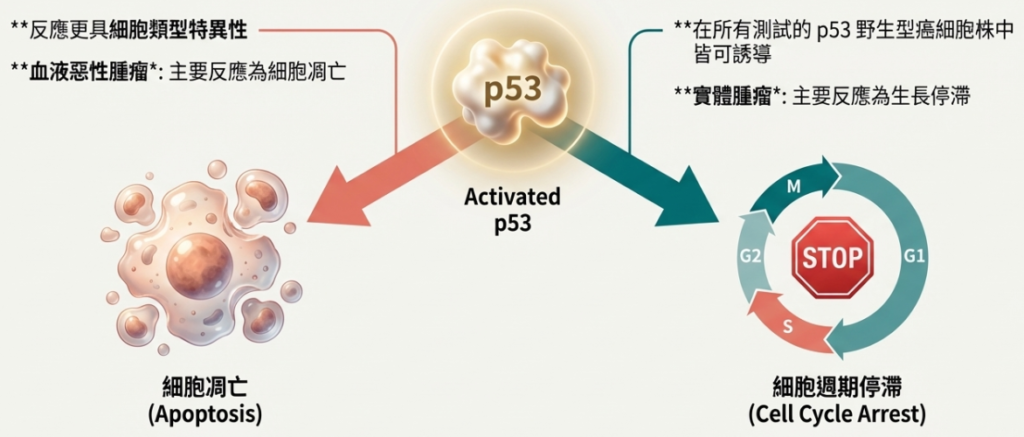
◦ 細胞類型差異: 反應取決於細胞類型。大多數血液惡性腫瘤(如急性骨髓性白血病 AML、B-CLL)對 Nutlin-3 引發的凋亡非常敏感,。相反,許多實體腫瘤(如肺癌、結腸癌)的主要反應是生長停滯而非凋亡,。
◦ 影響因子: MDM2 基因擴增的細胞通常對凋亡更敏感,但若細胞高表達 MDMX(另一種 p53 抑制蛋白),則可能對 Nutlin-3 產生抗性,因為 Nutlin-3 無法阻斷 p53 與 MDMX 的結合。此外,高 E2F1 活性或 PTEN 的表達也會增加細胞對 Nutlin-3 誘導凋亡的敏感性。
總結
| p53 狀態 | 主要反應機制 | 結果 (Outcome) | 關鍵分子/路徑 |
| 野生型 (Wild-type) | 阻斷 MDM2-p53 結合,穩定 p53 | 細胞週期停滯 (Quiescence/Senescence) 或 凋亡 | p21 (停滯); PUMA, Bax, 粒線體 p53 (凋亡); mTOR (決定衰老與否) |
| 突變/缺失 (Mutant/Null) | 阻斷 MDM2 與其他蛋白結合 | 凋亡 (通常需合併化療) 或 持續分裂 (對比正常細胞的停滯) | p73 (替代 p53 功能); E2F1 (促凋亡); MDM2-HIF1α (抗血管新生) |
您可以將 p53 想像成細胞內的「緊急煞車系統」,而 MDM2 就像是鎖住煞車的「安全插銷」,防止煞車隨意啟動。
• 在 p53 野生型的情況下,Nutlin-3 就像一把特殊的鑰匙,它插進安全插銷(MDM2)裡,迫使插銷鬆開。於是煞車系統(p53)被釋放,細胞這輛車就會停下來(細胞週期停滯)或者在無法修復時直接報廢(細胞凋亡)。
• 在 **p53 壞掉(突變/缺失)**的情況下,原本的煞車系統已經失靈了,所以拔掉插銷(MDM2)並不會直接啟動煞車。但是,Nutlin-3 拔掉插銷的動作可能會釋放其他備用系統(如 p73 或 E2F1),這些備用系統也能在一定程度上讓車子停下或報廢,特別是在配合其他破壞性手段(化療)的時候。
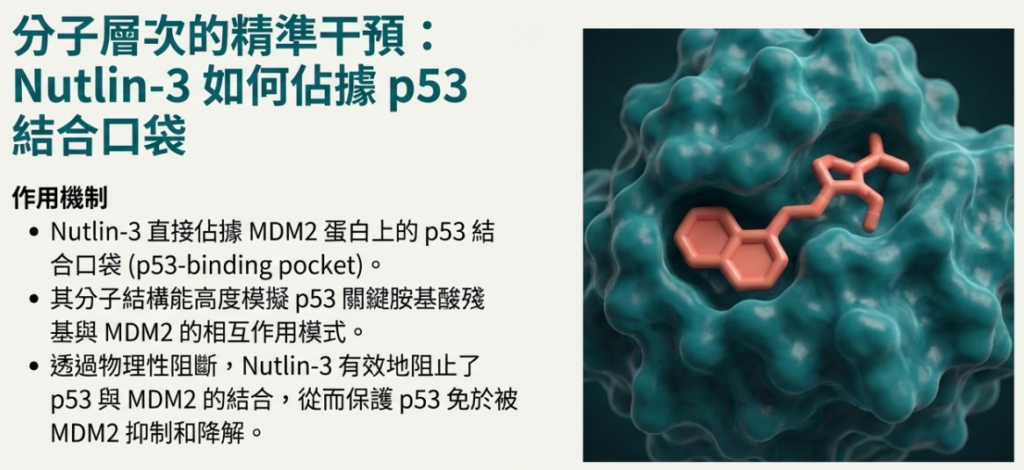
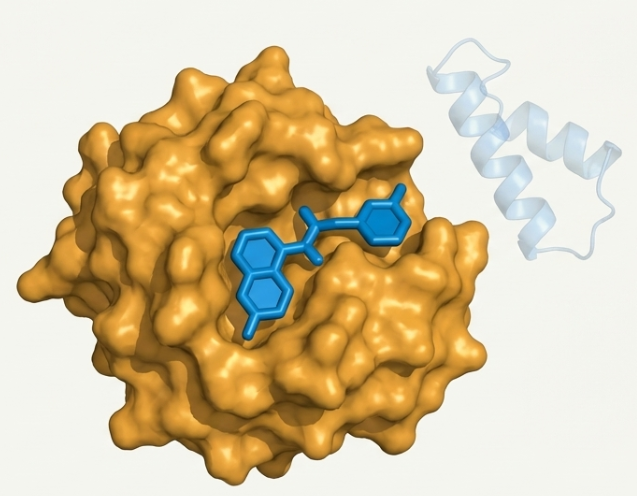
•• 結構模仿 p53 的三個關鍵疏水殘基:Phe19、Trp23、Leu26
什麼是p53
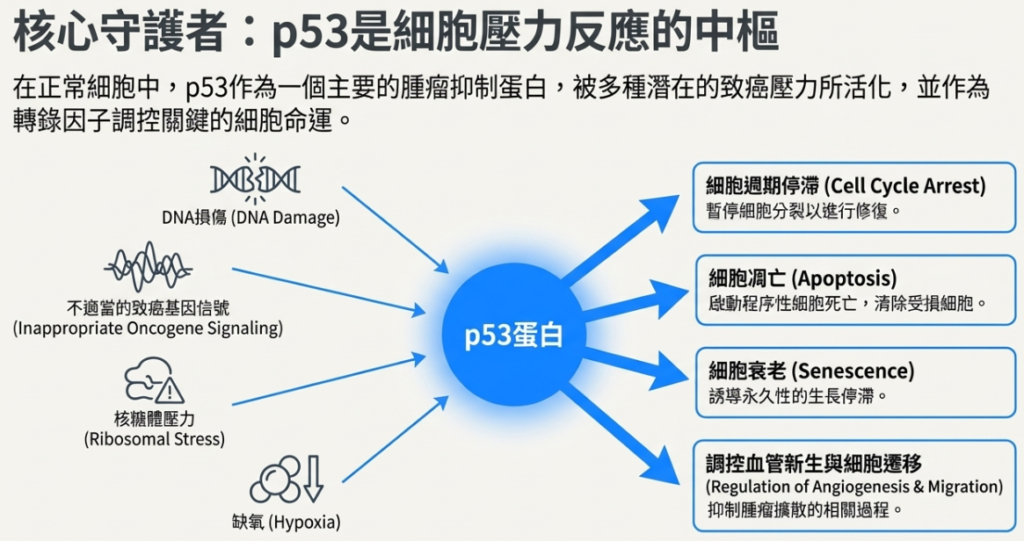
p53 signaling pathway 是一個精密且複雜的細胞監控網絡,被譽為「基因組的守護者(Guardian of the Genome)」。這個路徑的核心功能是感測細胞內的壓力與損傷,並做出決定:修復細胞、暫停生長,或者在無法修復時啟動自殺程序(凋亡),以防止癌症的發生。
p53 路徑的運作機制可以分為上游(活化訊號)、核心調控(與 MDM2 的互動)以及下游(效應反應)三個主要部分:
1. 上游:壓力的感測與 p53 的活化
在正常情況下,p53 蛋白的水平極低且不穩定。當細胞遭遇各種壓力時,p53 會被修飾(如磷酸化)並穩定下來,隨後大量累積。
• 觸發因子(Stress Signals):
◦ DNA 損傷: 由紫外線(UV)、輻射(γ-irradiation)或基因毒性藥物引起。
◦ 致癌基因活化(Oncogene activation): 如 MYC、Ras 或 E2F1 的異常訊號。
◦ 細胞環境壓力: 缺氧(Hypoxia)、營養匱乏(Nutrition deprivation)、熱/冷休克(Heat/cold shock)、一氧化氮(Nitric oxide)等。
◦ 核糖體壓力: 核糖體生物合成受阻時。
• 傳遞介質:
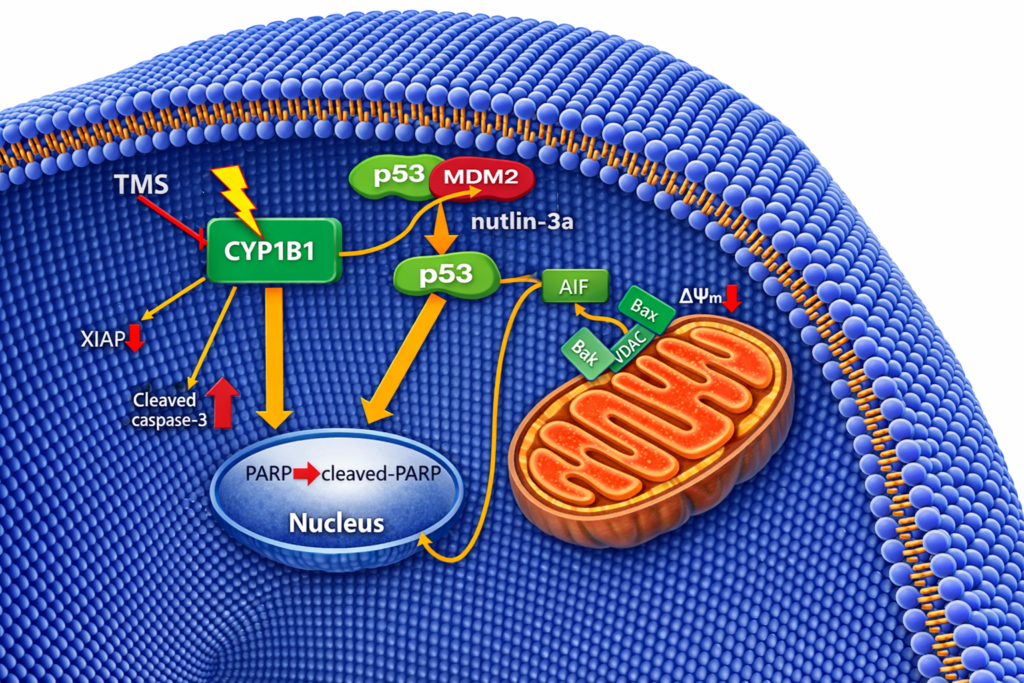
◦ 激酶系統: ATM、ATR、CHK1 和 CHK2 等激酶會磷酸化 p53,這通常發生在 DNA 損傷反應中。
◦ p14ARF: 當致癌基因異常活化時,會誘導 p14ARF 表達。p14ARF 會結合併抑制 MDM2,從而穩定 p53。
2. 核心調控:MDM2-p53 的回饋迴路
這是控制 p53 路徑最關鍵的「開關」。
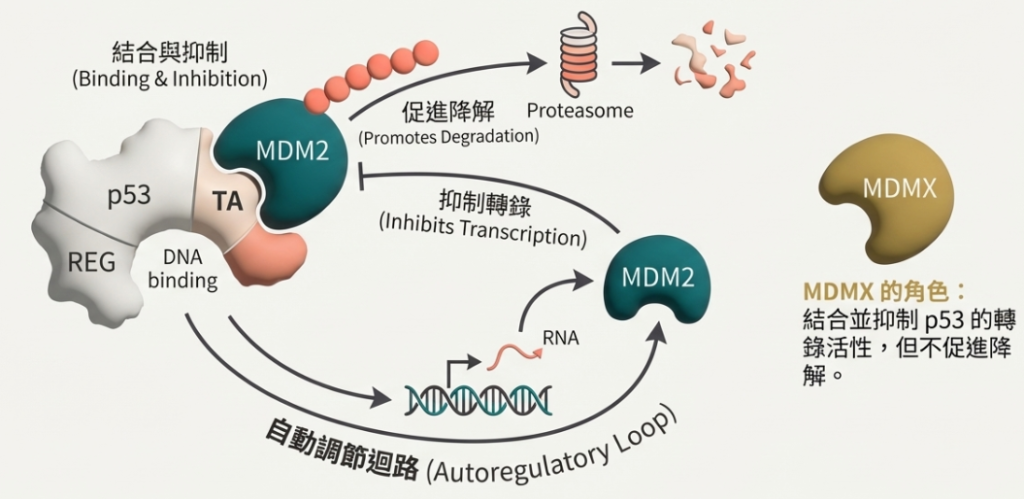
• MDM2 的抑制作用: MDM2 是一種 E3 泛素連接酶。它會結合 p53 的 N 端,主要透過兩種方式抑制 p53:(1) 阻斷 p53 的轉錄活性;(2) 給 p53 貼上泛素標籤(Ubiquitination),將其送往蛋白酶體(Proteasome)降解。
• 自動調節回饋(Auto-regulatory feedback loop): p53 作為轉錄因子,會促進 MDM2 基因的表達;而產生的 MDM2 蛋白反過來又會降解 p53。這個負回饋迴路確保了在沒有壓力時 p53 保持在低水平,而在壓力解除後 p53 能迅速恢復正常。
• MDMX 的角色: MDMX(或稱 MDM4)結構似 MDM2,能結合並抑制 p53 的轉錄活性,但不會降解 p53。它與 MDM2 協同工作來抑制 p53。
3. 下游:p53 的效應功能
一旦 p53 被活化並累積,它會作為轉錄因子進入細胞核,結合到 DNA 上啟動多種基因的表達,產生不同的生物學結果:
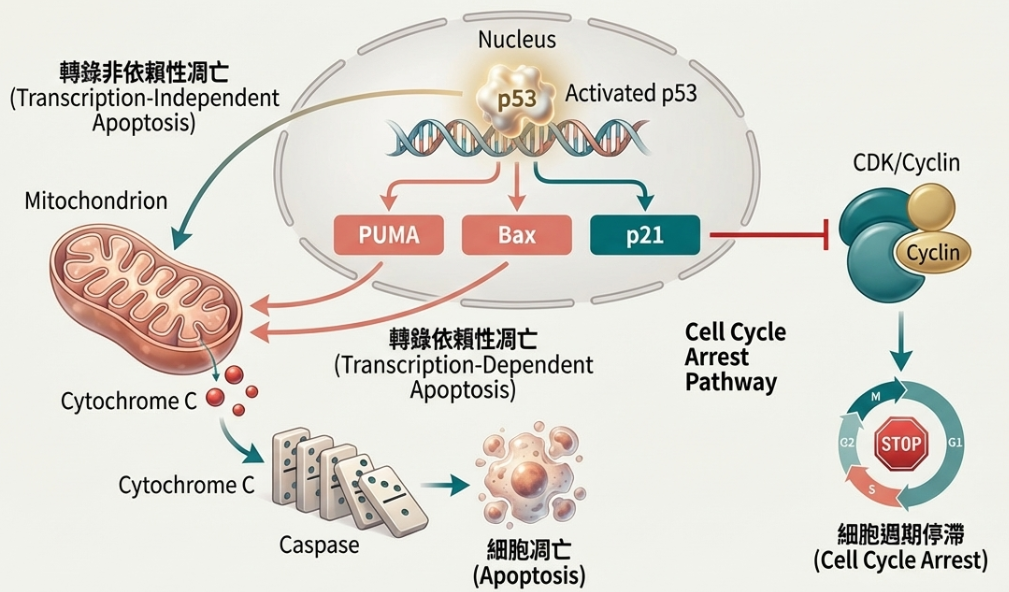
• 細胞週期停滯(Cell Cycle Arrest):
◦ G1 期停滯: p53 誘導 p21(CDKN1A)表達。p21 是一種 CDK 抑制劑,能抑制 Cyclin E/CDK2 和 Cyclin D/CDK4 複合物,阻止細胞進入 S 期。
◦ G2 期停滯: p53 調控 14-3-3-σ、Gadd45 和 Reprimo,阻止細胞進入 M 期(分裂期)。
• 細胞凋亡(Apoptosis):
◦ 轉錄依賴途徑: p53 啟動促凋亡基因如 PUMA、Noxa、Bax、Bid、Fas 和 DR5。這些蛋白會導致粒線體外膜通透化,釋放細胞色素 c(Cytochrome c),進而活化 Caspase 9 和 Caspase 3,執行細胞死亡。
◦ 非轉錄途徑: 部分 p53 直接移動到粒線體,與 Bcl-2 家族成員互作,直接觸發凋亡。
• 細胞衰老(Senescence):
◦ 透過 p21 和 PAI-1 等基因,使細胞進入永久性的生長停滯。這通常涉及 p53 透過上調 TSC2 和 PTEN 來抑制 mTOR 路徑。
• DNA 修復與代謝調節:
◦ p53 誘導 p53R2 等基因協助 DNA 修復。同時透過調節 TIGAR(抑制糖酵解)和 SCO2(促進氧化磷酸化)來管理細胞能量代謝。
• 抑制血管新生與轉移:
◦ 透過誘導 Maspin、AI-1 和 TSP1 等基因,抑制腫瘤的轉移和新血管生成。此外,如前所述,Nutlin-3 的研究顯示阻斷 MDM2 也能透過抑制 HIF-1α 來減少 VEGF 產生。
4. 臨床意義與 Nutlin-3
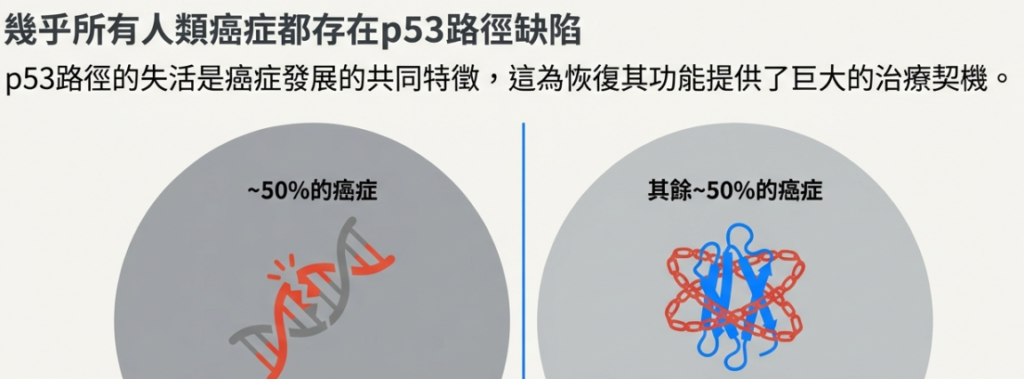
• 癌症中的突變: 約 50% 的人類癌症含有 p53 基因突變,使其失去功能。在剩下的 50% 中,p53 雖然是野生型,但常因 MDM2 或 MDMX 的過度表達而被抑制。
• Nutlin-3 的作用: Nutlin-3 是一種小分子藥物,能模仿 p53 結合 MDM2 的部位,從而物理性地阻斷 p53-MDM2 的結合。這使得 p53 在不造成 DNA 損傷的情況下穩定並活化,進而啟動上述的細胞停滯或凋亡路徑。

p53 pathway
Nutlin-3 的其他功用
•• 啟發後續 MDM2 抑制劑(如 RG7112、Idasanutlin)

📋 Nutlin-3 與 p53 / MDM2 Pathway 相關產品表 (Selleckchem) S1061 S8059 S8060
| 類別 | 產品名稱 | Cat. No. | Size* | 主要靶點 | 作用機制 | 研究定位 / 用途 |
|---|---|---|---|---|---|---|
| 核心產品 | Nutlin-3 | S1061 | 5 mg / 10 mg / 25 mg | MDM2 | 阻斷 MDM2–p53 PPI | 經典 p53 活化工具分子 |
| 活性對映體 | Nutlin-3a | S8059 | 5 mg / 10 mg | MDM2 | 高親和力 MDM2 抑制 | Nutlin-3 主要活性型 |
| 非活性對照 | Nutlin-3b | S8060 | 5 mg / 10 mg | MDM2 / MDMX | 低活性對映體 | 陰性對照(control) |
| 臨床前 | RG7112 | — | — | MDM2 | p53 穩定化 | 第一代臨床候選 |
| 臨床前 | Idasanutlin (RG7388) | — | — | MDM2 | 高選擇性抑制 | Nutlin 類後繼藥 |
| 臨床前 | SAR405838 | — | — | MDM2 | p53 活化 | 機轉比較 |
| 臨床前 | NVP-CGM097 | — | — | MDM2 | 抑制 p53 降解 | 藥效研究 |
| 臨床前 | Siremadlin (HDM201) | — | — | MDM2 | 強效抑制 | 新世代候選藥 |
| 工具分子 | Milademetan (DS-3032) | — | — | MDM2 | p53 re-activation | 合併治療 |
| 工具分子 | AMG 232 (KRT-232) | — | — | MDM2 | 高選擇性抑制 | 臨床前評估 |
| 工具分子 | Alrizomadlin | — | — | MDM2 | p53–MDM2 阻斷 | Pathway probe |
| 工具分子 | Brigimadlin | — | — | MDM2 | p53 stabilization | 藥效比較 |
| 工具分子 | MD-224 | — | — | MDM2 | 誘導 MDM2 降解 | 非典型機轉 |
| 工具分子 | SP141 | — | — | MDM2 | 直接降解 MDM2 | 差異化研究 |
| 研究對照 | SJ-172550 | — | — | MDMX | MDMX 抑制 | p53 調控對照 |
| 研究分子 | MX69 | — | — | MDM2 | 路徑調節 | 機制研究 |
| 研究分子 | RO8994 | — | — | MDM2 | p53 stabilization | 工具化合物 |
| 研究分子 | MMRi62 | — | — | MDM2 | 抑制 MDM2 | 探針 |
| 研究分子 | NSC 207895 | — | — | p53 pathway | 間接調控 | 機轉探索 |
| 研究分子 | YH239-EE | — | — | p53 pathway | 路徑調節 | 學術研究 |
*Size 為 Selleckchem 常見研究級包裝。
Selleckchem 是您研究 Nutlin-3、p53、MDM2 的最佳工具,歡迎來電翰新 02-28771122 訂購
Selleckchem Nutlin-3 文獻發表
- Cancer Discov,2025,15(1):69-82
- Cell,2024,187(10):2375-2392.e33
- Nat Biotechnol,2024,10.1038/s41587-024-02172-9
- Nat Metab,2024,6(2):323-342
- Cancer Discov,2023,13(2):432-453
- Nat Biotechnol,2022,10.1038/s41587-021-01172-3
- Nat Cell Biol,2021,23(6):595-607
- Cell Stem Cell,2018,23(4):544-556
- Nat Biotechnol,2017,35(6):577-582
- J Thorac Oncol,2014,9(9):1305-15
- Biomed Rep,2025,22(4):65
- J Biomed Sci,2024,31(1):90
- Stem Cell Res Ther,2024,15(1):485
- Commun Biol,2024,7(1):809
- Neoplasma,2024,71(3):255-265
- bioRxiv,2024,2024.07.24.604943
- Cell Prolif,2023,e13376.
- Cell Death Discov,2023,9(1):340
- J Biol Chem,2023,299(7):104908
- ProQuest,2023,30419365
- bioRxiv,2023,2023.01.17.524444
- Acta Pharm Sin B,2022,12(11):4165-4179
- Cell Death Differ,2022,10.1038/s41418-022-00992-3
- J Exp Clin Cancer Res,2022,41(1):79
- Cell Death Dis,2022,13(6):540
- Cell Commun Signal,2022,20(1):96
- Cell Biosci,2022,12(1):20
- Mol Cell Proteomics,2022,S1535-9476(22)00071-8
- iScience,2022,25(10):105182
- J Pers Med,2022,12(2)258
- Life Sci Alliance,2022,5(4)e202101157
- Hum Cell,2022,10.1007/s13577-022-00671-y
- Exp Dermatol,2022,10.1111/exd.14585
- Nat Commun,2021,12(1):3481
- Cell Death Differ,2021,10.1038/s41418-021-00886-w
- Cancer Lett,2021,S0304-3835(21)00481-X
- Cell Death Dis,2021,12(7):640
- Cell Death Dis,2021,12(1):1
- Mol Ther Nucleic Acids,2021,26:1280-1290
- Elife,2021,10e61630
- Eur J Med Chem,2021,217:113359
- Cancer Immunol Immunother,2021,10.1007/s00262-021-02940-5
- J Biol Chem,2021,S0021-9258(21)00730-4
- J Biol Chem,2021,S0021-9258(21)00965-0
- Sci Rep,2021,11(1):14253
- Hum Cell,2021,10.1007/s13577-021-00639-4
- Dis Model Mech,2021,dmm.049001
- Hum Cell,2021,10.1007/s13577-021-00579-z
- Hum Cell,2021,34(6):1911-1918
- Sci Adv,2021,7(32)eabf7561
- Cell Death Differ,2020,10.1038/s41418-020-0590-4
- Clin Cancer Res,2020,26(1):122-134
- Clin Transl Med,2020,10.1002/ctm2.41
- Cell Rep,2020,32(1):107845
- Cell Rep,2020,30(2):497-509
- Eur J Cancer,2020,126:93-103
- Cell Mol Gastroenterol Hepatol,2020,S2352-345X(20)30179-X
- Cancer Sci,2020,112(1):133-143
- Cancers (Basel),2020,12(11)E3205
- Cancers (Basel),2020,20;12(2) pii: E493
- Hum Cell,2020,10.1007/s13577-020-00420-z
- BMC Cancer,2020,20(1):617
- Virology,2020,539:1-10
- Leuk Lymphoma,2020,1-10
- J Vis Exp,2020,(156)
- Cell Death Differ,2019,10.1038/s41418-019-0338-1
- EBioMedicine,2019,45:251-260
- Cell Death Dis,2019,10(10):737
- Cell Rep,2019,29(5):1249-1260
- Oncogene,2019,38(14):2501-2515
- Oncogenesis,2019,8(12):67
- Oncologist,2019,24(7):989-996
- J Cell Mol Med,2019,23(7):4545-4558
- Oncol Rep,2019,41(2):1075-1082
- Mol Immunol,2019,108:68-74
- Nat Commun,2018,9(1):2494
- EBioMedicine,2018,36:252-265
- Cell Death Dis,2018,9(2):168
- Cell Rep,2018,22(12):3206-3216
- Oncogenesis,2018,7(3):33
- J Cell Physiol,2018,233(9):7424-7434
- Cell Physiol Biochem,2018,51(1):452-469
- Mol Biol Cell,2018,29(5):575-586
- Sci Adv,2018,4(12):eaat5077
- Leukemia,2017,31(6):1296-1305
- EMBO J,2017,36(23):3483-3500
- Cell Death Dis,2017,8(10):e3130
- Oncotarget,2017,8(25):41422-41431
- Sci Rep,2017,7(1):16652
- FEBS Lett,2017,591(18):2905-2918
Journal of Functional Foods,2017,31:217-228- Mol Cell,2016,63(3):526-38
- PLoS Genet,2016,12(9):e1006279
- Med Oncol,2016,33(10):113
- Hepatology,2015,62(5):1497-510
- Mol Ther,2015,23(5):857-65
